· 1,10フェナントロリンの鉄() 錯体はフェロイン (ferroin) と呼ばれ、電位の酸化還元指示薬(標準酸化還元電位 E 0 = 106 V) として滴定分析、吸光光度分析に用いられる試薬である。 合成 フェナントロリンは、スクラウプ反応で合成することができる。 硫酸を触媒としてグリコールとo2.1,10フェナントロリン塩酸塩を用いて,溶液を調製 最終濃度が 4x10−4 M になるように,メスフラスコに採取 3.CH 3 COOH-CH 3 COONa を用いて,pH~5 の緩衝溶液を調製 最終濃度が 01 M になるように,メスフラスコに採取 4.510 nm で吸光度測定 試料の測定 · フェナントロリンと二価の鉄の金属錯体の立体異性体を教えてください。 Fe(Ⅱ)(phen)₃ デルタとラムダの、光学異性体があります 解決済み 質問日時: 942 回答数: 1 閲覧数: 32 教養と学問、サイエンス > サイエンス > 化学 機器分析についての質問です。このような問題が
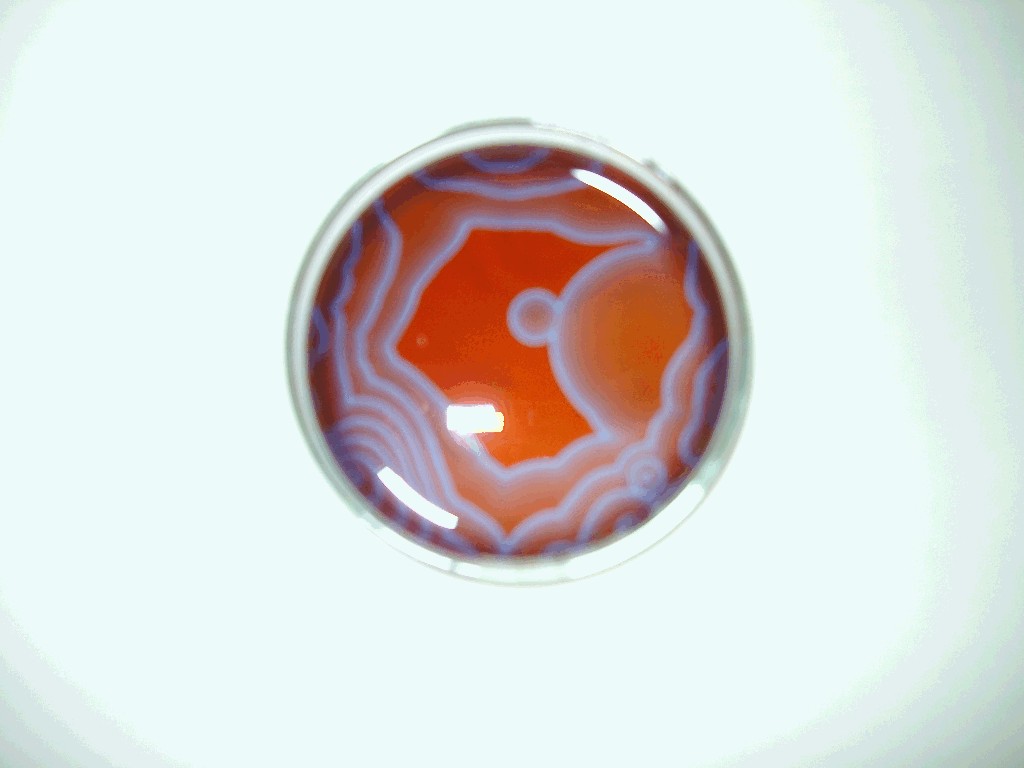
空間振動反応
1 10-フェナントロリン 鉄 錯体 色
1 10-フェナントロリン 鉄 錯体 色-チオシアナト鉄(iii)錯体、1,10フェナントロリン鉄(ii)錯体および銅(i)錯体などはこの例で、前者では から へ電子が移動して 基と を生成し、後者では金属の 電子が配位子の 軌道へ移動します。 · その際、鉄Ⅲイオンを塩酸ヒドロキシルアミンと反応させ鉄Ⅱイオンに還元してから、oフェナントロリンと反応させFe(ophen)32を生成させました。 鉄Ⅱイオンでも鉄Ⅲイオンでも錯体はつくれるが鉄Ⅱイオンの錯体の方が発色が良いから鉄Ⅲイオンを還元してから錯体をつくる、というのはわかっています。 では何故初めから鉄Ⅱイオンを使わなかった




Woa1 P Stacked Polymer And Complex Polymer Google Patents
1,10フェナントロリン鉄(ii)硫 酸塩 17 塩化水素 0 1215 水 97 注記:これらの値は、製品規格値ではありません。 危険有害成分 安衛法「表示すべき有害物」該当成分 塩化水素、1,10フェナントロリン鉄(ii)硫酸塩がフェロインの赤色とフェリイン(トリス1, 10フェナントロリン鉄錯体(III) (Ferriin) )の青色の間で、 時間とともに交互に色が変わるのが観察され、時間的化学振動を示す。1,10‐フェナントロリンとFe2、第一鉄トリス(‐フェナントロ リン)鉄(II)またはFe(phen) 32によって形成される錯体は明 るいオレンジ色です。錯体の構造の3Dモデルを図2に示します。 鉄は、 Fe2(第一鉄イオン)の形態に加えて、3(第二鉄イ
1,10フェナントロリンの鉄 錯体はフェロイン (ferroin) と呼ばれ、電位の酸化還元指示薬(標準酸化還元電位 E 0 = 106 V) として滴定分析、吸光光度分析に用いられる試薬である。 合成 フェナントロリンは、スクラウプ反応で合成することができる。!) No281 50 10 30 281 mg/l 検知剤(白色) 干渉物質 6価クロム 100mg/l以下 影響しない 100mg/l以上で淡黄色に変色 アルミニウム 50mg/l以上 + 100mg/lで変色しない コバルト 100mg/l(1) 薬品:実験1で作った2価の鉄イオンを含む薄い緑色の溶液、(次 の5つの溶液は霧吹きに入っている。)フェナントロリン、 ビピリジンおよびテルピリジンのアセトン溶液、tptz(右 図参照)のエタノール-アセトン(1:1)溶液、ヘキサシ
· 結果、ヘキサシアノ鉄(iii)酸カリウムを噴霧した方は青色に、1,10ーフェナントロリン溶液の方はオレンジ色になりました。 この色の変化ってどのような錯体ができたためですか?? わかる方いましたら、回答よろしくお願いします。鉄鉱石中の鉄(第1鉄,第2鉄)の1,10フェナントロリンによる吸光光度定量 CORE Reader鉄は低スピンの電子配置をとり、d 3 対称の八面体配位をとっている。フェロイン錯体の特徴的な色は、金属イオンと配位子の間の電荷移動遷移に起因する。 関連項目 酸化還元指示薬;




オルトフェナントロリンの意味 用法を知る Astamuse




Woa1 P Stacked Polymer And Complex Polymer Google Patents
連続変化法による鉄 (II) と 1, 10フェナントロリン錯体系の分光学的組成決定 野々山 松雄 化学と教育 44(12), , 19962.フェナントロリン吸光光度法による鉄の定量 2価の鉄はフェナントロリンとキレートを作り赤橙色を示します。この発色した溶液の吸光度から、溶液中の鉄の濃度を知ることができます。 Fe 2 3phen → Fe(phen) 3 2 phen =1,10phenanthrolines Chemical class 0000 title claims abstract description 77;



質問箱




空間振動反応
1,10フェナントロリンを用いる鉄の比色定量におけるpH調節と鉄の状態について 1) F J Welcher "Organic Analytical Reagents", Vol III, p (1948), (D Van Nostrand Company, Inc, New York) E B Sandell "Colorimetric Determination of Traces of Metals", 3rd Ed, p 540 (1959), (Interscience Publishers, Inc, New York) · 10 , 1:9 , 2:8・5:5・9:1,10:〔〕等)を,縦 軸に吸光度を図示する。生成した錯体の組成 (71の 値)と510nmのモ ル 吸光係数 (ε)の値を求める。 結果と考察 phen とFe(II)を混合した溶液は橙色でその可視領 域の吸収スベ ク1・ルの例を図2に示す。Ligands Substances 0000 title claims abstract description 24;




Patentimages Storage Googleapis Com 12 42 35 7d



151 33 7 1 10 フェナントロリン塩酸塩一水和物 1 10 Phenanthroline Hydrochloride Monohydrate 168 164 166 160 詳細情報 常用試薬 ラボウェア 試薬 富士フイルム和光純薬
Coordination complex Chemical class 0000 claims abstract description 12;Polymerization reaction Methods 0000 claims abstract description 24;Binding Effects 0000 title claims abstract description 24;



公表特許公報




Woa1 過酸化水素製造方法 過酸化水素製造用キットおよび燃料電池 Google Patents
1,10フェナントロリンの鉄(II) 錯体はフェロイン (ferroin) と呼ばれ、電位の酸化還元指示薬(標準酸化還元電位 E0 = 106 V) として滴定分析、吸光光度分析に用いられる試薬である。 Property Value;1)色を忠実に再現する指標:(演色評価数) 2)明るさの Type 1のEu(III)錯体は、大きな縮合環である1, 10フェナントロリンの影響で媒体に対する溶解性 が極めて小さい。一方、Type 2 のEu(III)錯体は、光吸収効率が小さいため十分な蛍光強度を得る ことができない。そこで我々は、配位子としCoordination Chemistry §1 錯体化学の基礎 1 金属錯体とは 2 金属錯体の構造 3 金属錯体の異性現象 4 化学式と命名法




16 号 酸素還元触媒 Astamuse




Pdf Electrochromism Of Coordinated Metal Complex
Membrane Substances 0000 title abstract 4;Manufacturing process Methods 0000 title claims description 5トリス (1,10フェナントロリン)鉄 (Ⅱ)錯体 (tris (1,10phenanthroline)iron (Ⅱ)錯体) Fe (C 12 H 8 N 2) 3 2+ のことで,鉄が酸化されて三価になった錯体をフェリイン (ferriin)という.鉄が二価状態で赤色を,三価状態で淡青色を呈する.




パックテスト 鉄 低濃度 パックテストの共立理化学研究所




07 号 光学記録媒体 光記録材料および金属錯体化合物 Astamuse
(参考)Fe2+の1,10 -フェナントロリン錯体 のモル吸光係数 ε=117 ×10 4 L/(mol・cm ) 文献値 解説 この実験は、鉄(Ⅱ)イオンFe2+が1,10 -フェナントロリンと反応して、 Fe2+:phen=1:3の金属キレートを生成する反応を利用している。 この金属錯体は長時間変化せず安定で、1,10Dboabstract フェナントロリン (phenanthroline, phen) は、フェナントレンの炭素のうち2つを窒素1,10-フェナントロリンと錯体を形成するのは2価の鉄のみです。鉄は水溶液中で3価で 存在することがあるので、還元剤として塩化ヒドロキシルアンモニウムを添加しています。 この実験は、1,10ーフェナントロリン吸光光度法としてよく用いられています。吸光光度計があれば波長510nmで測定してみてください。 鉄分の他にカルシウム、ビタミン類などを含んだ飲料




パックテスト 10回分入り 鉄 低濃度 パックテストの共立理化学研究所




パックテスト 徳用セット 鉄 パックテストの共立理化学研究所
Discuss1 1,10phenanthroline metal complex Chemical class 0000 title claims description 28;1,10フェナントロリンの鉄 錯体はフェロイン (ferroin) と呼ばれ、電位の酸化還元指示薬(標準酸化還元電位 E 0 = 106 V) として滴定分析、吸光光度分析に用いられる試薬である。 合成 編集 フェナントロリンは、スクラウプ反応で合成することができる。鉄(II)イオンとoフェナントロリンの1:3錯体 は濃赤色で,微量の鉄(II)イオンの検出に利用され, またこの濃赤色は鉄(III)錯体になるとあざやかに 変色(淡青色)するので,酸化還元指示薬(フェロ イン)として用いられる16。なお,ophen配位子




フェナントロリンの意味 用法を知る Astamuse



マイクロアッセイ Uibc 不飽和鉄結合能 キット バソフェナントロリン法 Metallogenics
として直接試験管に入れる)。光路が1 cm の場合、直線性は終濃度5 ppm ぐらいまで (つまりサンプル濃度は10 ppm まで)。 ・oフェナントロリン溶液 oフェナントロリン塩酸塩一水和物0024 g を mL の水に溶かす。 (塩酸塩で無い場合は002 g とする)Fe2++1,10フェナントロリン(白色)→錯体(橙色) 反応原理 鉄標準溶液 校正用物質 仕 様 浸漬法検知管 2価鉄Fe2+ Iron(!!)ion No281 50 10 30 281 mg/l 検知剤(白色) 干渉物質 6価クロム 100mg/l以下 影響しない 100mg/l以上で淡黄色に変色 アルミニウム 50mg/l以上 + 100mg/lで変色しない コバルト 100mg/02/12 · 1,10フェナントロリンを用いて Fe(II) を錯体とし,10 cm の試料セルを使用してその吸光度を測定したら 060 であった。鉄(II)錯体 のモル吸光係数を計算せよ。ただし,鉄(II)錯体の分子量は 596 である。 06=ε×10×(30×1




16 号 酸素還元触媒 Astamuse



参加 参加取り消し 登録システム 未来の科学者養成講座 科学先取り岡山コース
· 化学 Fe2と1,10フェナントロリンにより錯体を形成させて吸光度を測定する際に,30分・60分・90分と時間を置いているのですが,机の上に出しておく(蛍光灯とか日光にあたって鉄イオン は,3分子の1,10フェナントロリンと錯体を形成する。配位結合は1,10フェナントロリンの2個の 窒素との間で生じる。この時の鉄イオンは,d2sp3浬成軌道による正八面体構造(双四角錐型,双ピラ ミッド型)の配位をする。この錯体の立体的な構造フェナントロリン フェナントレンの2個の炭素原子を窒素原子で置換した化合物。 3種類の異性体がある。 o‐フェナントロリンは白色の 結晶 で,融点117℃,沸点300℃以上。 エタノール に可溶。 金属イオンと安定な キレート化合物 を作り,特に第一鉄イオン(Fe 2 (/))により赤色を呈する。 金属の定量, 酸化還元指示薬 に使用。 (図) 出典 株式会社平凡社



マイクロアッセイ Uibc 不飽和鉄結合能 キット バソフェナントロリン法 Metallogenics




エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com
Fe2++1,10フェナントロリン(白色)→錯体(橙色) 反応原理 鉄標準溶液 校正用物質 仕 様 浸漬法検知管 2価鉄Fe2+ Iron(!鉄(II)−1,10−フェナントロリン錯体はpH25〜9で安定であり,発色強度は鉄(II)の量に比例する。濃 度と吸光度の直線 モル吸光係数の計算方法 共著者:Xスタッフトレーニングを受けた編集者および研究者のチームがこの記事を執筆し、その正確さと幅広さを検証しました。 この記事では、10個の




Woa1 単核金属錯体 水素化還元触媒 脱水素用触媒 水素化還元生成物の製造方法 水素 H2 の製造方法および脱水素反応生成物の製造方法 Google Patents




Woa1 P Stacked Polymer And Complex Polymer Google Patents




Wo1768a1 ニッケル コバルト含有複合化合物の製造方法 Google Patents



特許 知財ポータル Ip Force




まるでアート 美しすぎる化学の 振動 Bz 反応 Youtube
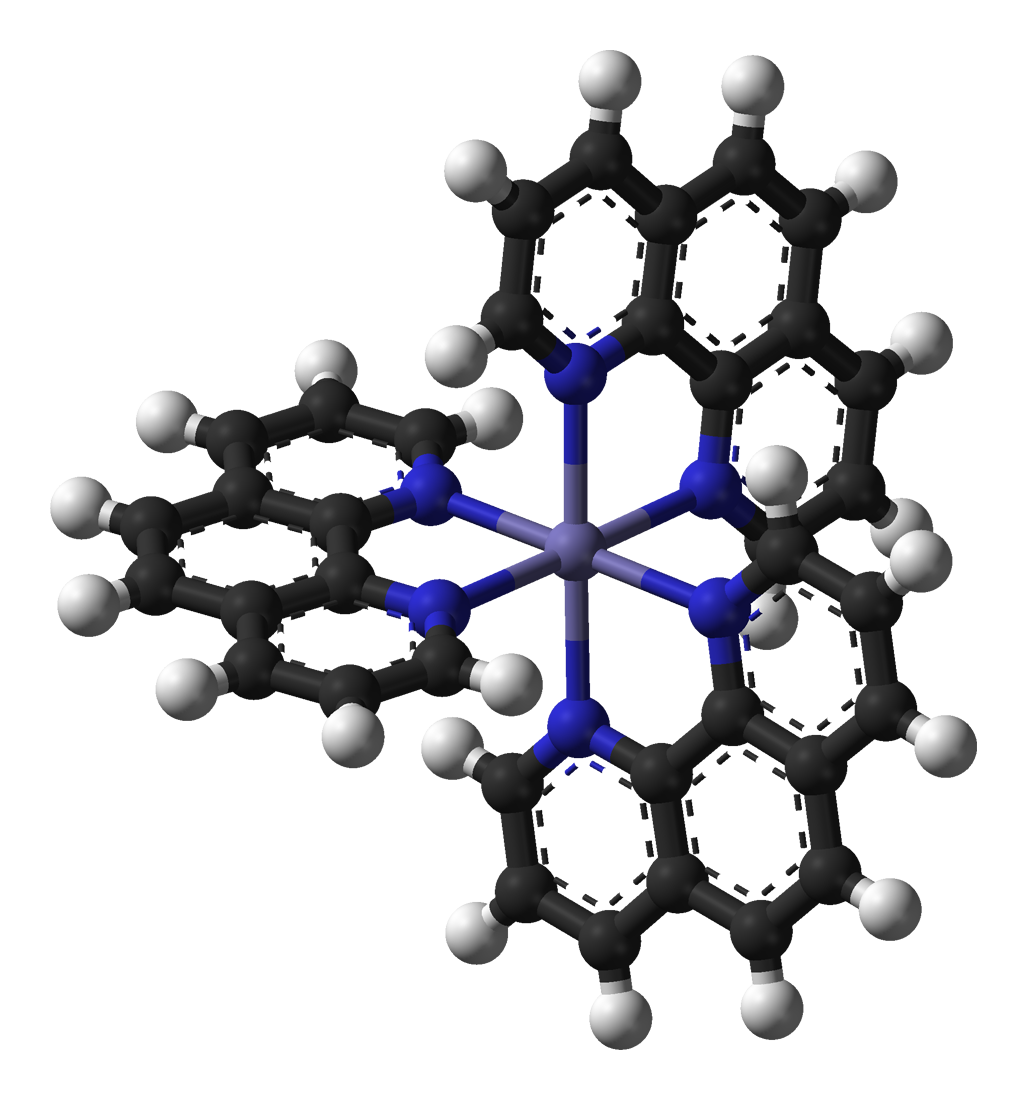



フェロイン Wikipedia




10 9 塩化鉄 Ii 四水和物 Iron Ii Chloride Tetrahydrate 095 099 詳細情報 常用試薬 ラボウェア 試薬 富士フイルム和光純薬



Blogjpmbaheqynf 最新 フェナントロリン 鉄 錯体 2240 フェナントロリン 鉄 錯体 化学式



H24 6班 ハッ 振動反応




Woa1 単核金属錯体 水素化還元触媒 脱水素用触媒 水素化還元生成物の製造方法 水素 H2 の製造方法および脱水素反応生成物の製造方法 Google Patents




フェナントロリン Wikipedia




Images Of 1 10 フェナントロリン Japaneseclass Jp




シュウ酸第二鉄カリウム Wikipedia




非線形化学反応 一般財団法人宇宙システム開発利用推進機構




Woa1 P Stacked Polymer And Complex Polymer Google Patents




1994 2815号 鉄イオンの価数別分析方法 Astamuse



H28 1班 世にも奇妙な 振動反応 ここなっつぱいん



3回生実験のこと 光吸収 1 2



0 件のコメント:
コメントを投稿